PRINCIPAUX ENSEIGNEMENTS DU FORUM CDKL5 2025
2 novembre
Depuis onze ans, la Loulou Foundation organise chaque année le Forum CDKL5, où scientifiques et développeurs de médicaments travaillant sur le déficit en CDKL5 (CDD), cliniciens et représentants d’associations de patients se réunissent pour discuter des dernières avancées dans ce domaine et progresser vers des traitements et des remèdes. Vous trouverez sur notre site web les comptes rendus des dernières éditions : 2018, 2019, 2020, 2021, 2022, 2023 et 2024.
L’édition 2025 du Forum CDKL5 s’est tenue les 27 et 28 octobre à Boston et se déroulera à nouveau à Londres l’année prochaine pour l’édition 2026. Ce forum a, une fois de plus, réuni le plus grand nombre de participants à ce jour, avec plus de 200 personnes, dont des représentants de 27 entreprises et de 22 associations nationales de patients.
Je vais tenter de résumer les principaux enseignements du Forum de cette année. Ce résumé ne couvrira pas toutes les présentations ; je m’excuse donc par avance auprès des scientifiques et médecins dont je ne pourrai pas aborder les travaux. Je me concentrerai sur les thèmes principaux et les avancées majeures en matière de traitements.
1 Approfondissement de nos connaissances (utiles) sur CDKL5
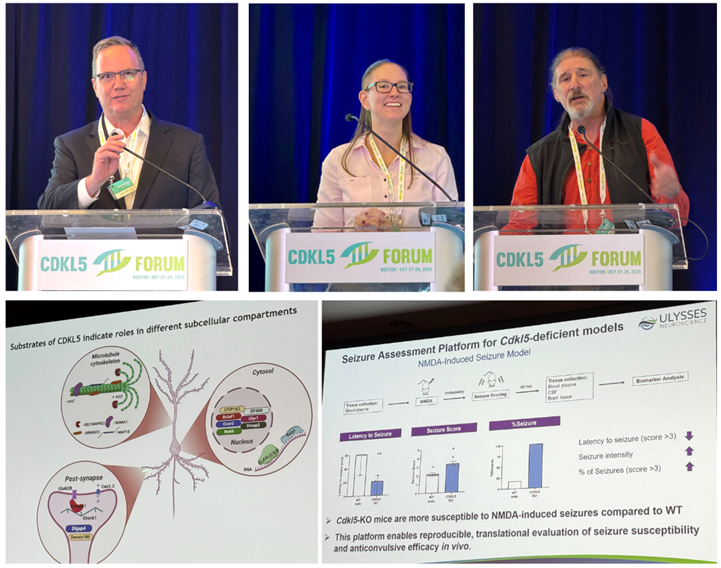
Image: Forum Director Dr Dan Lavery (Loulou Foundation); Dr Enya Paschen (Ulysses Neuroscience); Prof Peter Kind (University of Edinburgh); summary of some CDKL5 direct targets; Ulysses Neuroscience seizure platform.
Avant ce Forum 2025, je pensais que nous avions peut-être déjà découvert l’essentiel de ce qu’il fallait savoir sur le fonctionnement de la kinase CDKL5, et que par conséquent, toute nouvelle découverte n’aurait que peu d’impact. Quelle erreur ! Lors de ce Forum, nous avons appris de nombreuses découvertes sur les rôles de CDKL5, bien plus importants que ce que nous imaginions. Nombre d’entre elles sont utiles pour la conception de traitements.
Par exemple, nous avons appris qu’une découverte réalisée simultanément dans deux pays a révélé que CDKL5 contrôle une protéine qui se lie à l’ARN. Cela signifie que lorsque CDKL5 est active, elle n’active et ne désactive pas seulement d’autres protéines (comme le font les kinases), mais elle contrôle également la quantité de protéines produites. CDKL5 est également impliquée dans l’autophagie, un processus par lequel les cellules éliminent les agrégats protéiques. Il s’agit donc d’un autre moyen de réguler la quantité de protéines présentes dans la cellule. Un autre laboratoire a découvert comment CDKL5 contrôle plusieurs protéines synaptiques grâce à un domaine de type Velcro qui se lie à ces protéines (un domaine de liaison PDZ). Ces nouvelles fonctions s’ajoutent à celles déjà connues, comme le contrôle du canal ionique Cav2.3 par CDKL5 ou sa modulation de la dynamique et de la plasticité des microtubules.
Pour les scientifiques comme moi qui travaillons au développement de thérapies, la carte du champ d’investigation s’élargit constamment, offrant toujours plus de nouvelles cibles et, par conséquent, de nouvelles pistes thérapeutiques à explorer. Cette complexité accrue pourrait sembler négative, mais elle est en réalité une excellente nouvelle. Nous avons également assisté à une présentation d’Ulysses Neurosciences sur leur plateforme de tests murins pour la CDD, incluant des mesures comportementales chez les souris mâles et femelles, ainsi que des enregistrements de crises d’épilepsie et d’EEG, ce qui facilitera l’évaluation de toutes ces options thérapeutiques.
En résumé : les scientifiques continuent d’explorer les zones d’ombre de la biologie de CDKL5, et chacune de ces nouvelles découvertes constitue un indice potentiel pour le développement de thérapies contre la CDD. Le Forum 2025 a été particulièrement fructueux à cet égard, avec de nombreuses découvertes biologiques.
2. Plus d’options que jamais pour accéder à de nouveaux médicaments
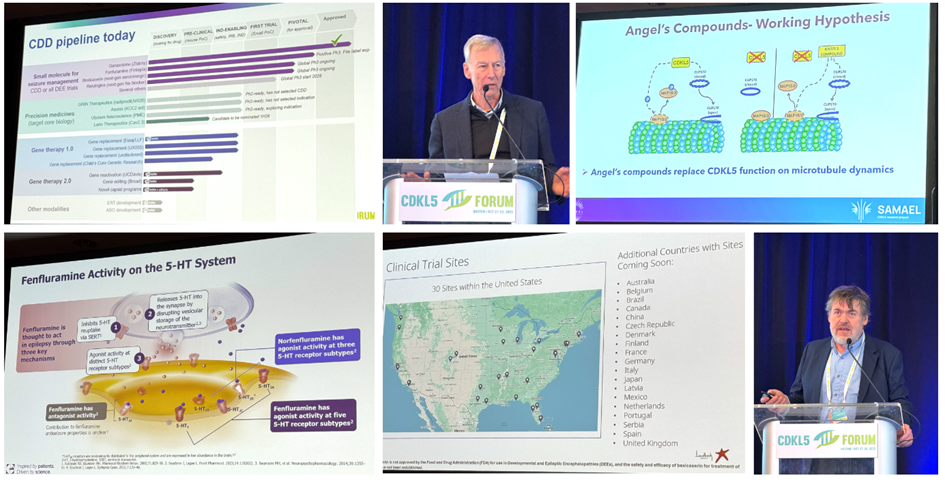
Image: CDD pipeline listing most programs in development; moderator Prof Orrin Devinsky (NYU Langone); Angel Neurotherapeutics program; fenfluramine activity (UCB Pharma); Bexicaserin trial recruitment sites (Lundbeck); Praxis CSO Prof Steve Petrou.
Lors de son discours d’ouverture, le Dr Dan Lavery de la Fondation Loulou a présenté une diapositive illustrant le développement de traitements contre la CDD, montrant plusieurs générations de médicaments à petites molécules et de thérapies géniques, tous en phase d’essais cliniques ou en voie d’y parvenir.
Et surtout : en 2025, nous aurons un médicament approuvé, un deuxième ayant achevé avec succès les essais de phase 3, et deux essais internationaux de phase 3 recrutant activement des patients atteints de CDD. Jamais auparavant une année comme 2025 n’avait été aussi prometteuse.
C’est la première année que nous avons accueilli Immedica au Forum, suite à l’acquisition de Marinus. L’équipe d’Immedica a présenté ses conclusions concernant une titration plus lente du ganaxolone afin de réduire les effets secondaires. Le ganaxolone est déjà commercialisé aux États-Unis, et Immedica travaille à son accès au marché dans d’autres pays.
Cet été, UCB Pharma a annoncé les résultats positifs de son essai de phase 3 sur la fenfluramine. Lors du Forum, l’entreprise a présenté le mécanisme d’action complexe de la fenfluramine, qui implique plus que le seul récepteur de la sérotonine 5-HT2C. Les résultats précis de l’essai sur le syndrome de Cushing seront annoncés lors du congrès de l’American Epilepsy Society en décembre ; nous les suivrons donc de près. UCB déposera une demande d’extension d’indication pour la fenfluramine afin d’y inclure également le traitement des crises d’épilepsie associées au syndrome de Cushing.
L’année dernière, les agences réglementaires ont autorisé les entreprises à mener des essais cliniques combinant différents syndromes épileptiques, et non plus un seul à la fois. Cette mesure a permis d’élargir les possibilités d’essais cliniques.Ces essais, qui exigent seulement quatre crises comptées par mois et incluent aussi bien les enfants que les adultes, offrent désormais un choix plus vaste que jamais pour tester de nouveaux médicaments contre l’épilepsie dans le cadre d’essais cliniques. Lors du Forum, nous avons pu observer deux vastes essais de phase 3 actuellement en cours de recrutement dans de nombreux pays :
Lundbeck mène l’essai de phase 3 DEEp OCEAN avec son médicament bexicaserin. Ce dernier cible l’un des récepteurs de la fenfluramine, le 5-HT2C, et a démontré une très bonne efficacité lors de l’essai de phase 2, également sur un ensemble de syndromes. L’étude compte une centaine de centres aux États-Unis, en Australie, en Europe et en Asie. Voici le lien vers l’étude : https://deepdeestudy.com/
Praxis mène l’essai de phase 3 EMERALD avec son médicament relutrigine. La relutrigine est un bloqueur des canaux sodiques de nouvelle génération présentant de nombreux avantages : pas de titration nécessaire, une seule prise par jour, formulation liquide, et la possibilité de participer à l’essai à domicile – un médecin et une infirmière se déplacent chez vous. L’essai est mené dans de nombreux pays et le site web est disponible en 12 langues. Voici le lien vers l’étude : https://www.resiliencestudies.com/emerald
Outre cette première génération de traitements, tous conçus pour réduire la fréquence des crises, nous avons eu un aperçu de ce qui pourrait se présenter dans quelques années : les médicaments de précision pour le CDD. Il s’agit de médicaments capables de corriger certains aspects clés de la biologie du CDD. Cette année, le Dr Massimiliano Bianchi, d’Angel Neurotherapeutics, a présenté leurs travaux précliniques sur un médicament appelé PME et ses analogues. Ces médicaments se lient aux protéines de liaison au cytosquelette pour compenser la perte de CDKL5, et le médicament le plus avancé pourrait faire l’objet d’essais cliniques dans le CDD d’ici 2027. C’est l’une des nombreuses initiatives visant à ce que les médicaments de précision pour le CDD atteignent les essais cliniques d’ici deux ans environ. Ciblant des aspects clés de la biologie du CDD, ils devraient également améliorer les symptômes non épileptiques, comme l’a démontré le programme phare d’Angel.
En résumé : les familles touchées par le CDD ont aujourd’hui un accès sans précédent aux nouvelles thérapies expérimentales. Ceci inclut également les patients adultes qui n’étaient pas éligibles aux essais cliniques jusqu’à présent.
3. Progrès de la thérapie génique et leçon de sécurité
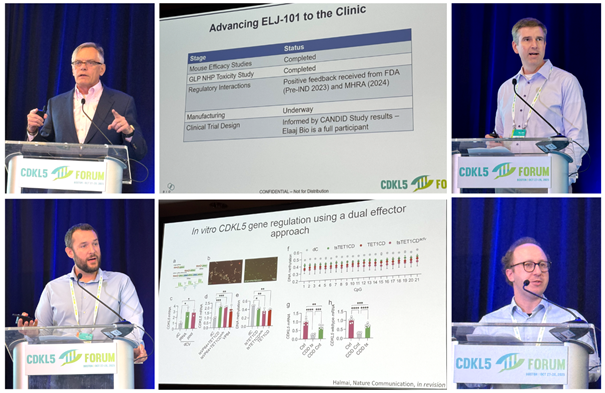
Image: Keynote speaker and moderator Prof Jim Wilson (Gemma Bio); Elaaj gene therapy program (Loulou Foundation); Dr Russ Addis (Loulou Foundation); Dr Kyle Fink (UC Davis); UC Davis X reactivation project; Andrew Steinsapir (Apertura Gene Therapy)
La thérapie génique demeure l’un des principaux sujets abordés lors du Forum CDKL5, et cette année, nous avons reçu des messages mêlant enthousiasme et prudence. Certains membres de l’Alliance présents à la conférence m’ont confié avoir eu l’impression d’échanger en toute transparence, ce qui leur a permis de constater que les progrès en thérapie génique pour le CDD étaient plus concrets et tangibles que jamais.
Nous avons été informés des avancées concernant TROIS thérapies géniques pour le CDD actuellement en développement :
- Le Dr Sharyl Fyffe-Maricich, d’Ultragenyx, a présenté leur programme de thérapie génique, abordant la question cruciale de l’absence de calendrier précis pour le lancement des essais cliniques. Elle nous a toutefois fait une précieuse contribution scientifique en partageant leurs recherches sur des singes, démontrant que les neurones produisant déjà du CDKL5 peuvent en synthétiser davantage grâce à la thérapie génique. Cette découverte est importante pour les nombreux patients atteints de CDD porteurs de mutations faux-sens, qui produisent du CDKL5 mais celui-ci est non fonctionnel car il comporte un acide aminé erroné. Les recherches de Sharyl indiquent qu’ils présenteront probablement un mélange de protéines CDKL5, certaines provenant de leur gène muté et d’autres de la thérapie génique ; c’est donc très positif. J’ai été très soulagée et reconnaissante d’apprendre les résultats d’Ultragenyx.
- Le Dr Russ Addis, de la Fondation Loulou, a présenté les dernières avancées en matière de thérapie génique développée par la Fondation. Cette thérapie génique a été mise au point en collaboration avec le Professeur Jim Wilson, à l’aide d’un virus très similaire à l’AAV9, actuellement utilisé dans quatre autres essais cliniques. Ce virus contient une copie du gène CDKL5 et est administré par injection dans le liquide céphalo-rachidien. Russ nous a présenté les études de recherche de dose chez des souris atteintes de CDD, visant à identifier la dose clinique optimale, et nous a indiqué que les études de toxicologie chez les singes étaient terminées. La Fondation Loulou a entamé la production à grande échelle de la thérapie génique en vue des essais cliniques et travaille déjà à la conception de ces essais. Russ a expliqué que la fabrication prendra « la majeure partie de l’année », c’est pourquoi nous prévoyons une autorisation d’essai clinique vers la fin de 2026 afin de débuter les essais en 2027. La Fondation Loulou a annoncé un partenariat avec Gemma Bio, la société de Jim Wilson, pour partager les données d’autres thérapies géniques utilisant la même approche et actuellement en essais cliniques. Afin de faire progresser ce programme et d’autres programmes de thérapie génique, la Fondation Loulou a créé une filiale appelée Elaaj Bio, qui, comme l’a indiqué Russ, a pour « ambition d’offrir aux familles et aux patients plusieurs options et un meilleur accès à ces traitements ».
- Le Dr Kyle Fink de l’UC Davis et son laboratoire développent une thérapie génique très prometteuse pour le syndrome CDD : la thérapie de réactivation du chromosome X. Elle utilise un virus pour délivrer à chaque neurone les instructions nécessaires à la lecture du deuxième gène CDKL5 situé sur le deuxième chromosome X, présent chez toutes les femmes. Ces instructions sont de type CRISPR. Il nous a rappelé l’efficacité de sa thérapie génique chez les souris atteintes du syndrome CDD et les progrès réalisés pour transposer cette découverte murine en traitement humain. Ces progrès incluent la détermination des doses optimales et la vérification de son efficacité sur les neurones humains (à l’aide d’organoïdes dérivés de patients). La production a commencé et les études de toxicologie sur les singes débuteront prochainement, en vue des essais cliniques. Cette version de la thérapie génique utilise une combinaison de deux virus administrés dans le liquide céphalo-rachidien (LCR), mais Julian Halmai (également professeur à l’UC Davis) travaille avec Kyle à la création d’une version miniature de la thérapie CRISPR qui permettra, à terme, de n’utiliser qu’un seul virus.
Nous avons également appris qu’un programme de thérapie génique a été interrompu.
Ce fut une surprise intéressante. Ashton Brennecke, de Biogen, a expliqué comment Biogen avait travaillé en secret sur une thérapie génique pour le CDD, et que, suite à l’arrêt du programme, l’entreprise souhaitait partager certains de ses enseignements avec la communauté scientifique. Leur thérapie génique était très similaire à celles d’Ultragenyx et de la Fondation Loulou, et ils ont étudié l’utilisation de l’EEG chez la souris comme indicateur d’efficacité. Il était très intéressant d’apprendre comment ils ont optimisé les méthodes EEG pour évaluer l’efficacité de la thérapie génique, mais aussi triste de constater que Biogen rejoint Amicus et PTC Therapeutics parmi les entreprises ayant entrepris des thérapies géniques pour le CDD avant d’entamer les essais cliniques. Ce type d’abandon est fréquent dans le développement de thérapies, et explique pourquoi il est essentiel de multiplier les tentatives.
Et surtout, nous avons appris ce que le domaine a découvert depuis le premier essai de thérapie génique chez un patient dans les années 90.
Le professeur Jim Wilson, pionnier du développement de la thérapie génique, a donné une présentation remarquable sur l’histoire et les enseignements tirés de ce domaine. Ancien directeur du Centre des maladies orphelines de l’Université de Pennsylvanie et actuel PDG de Gemma Bio, société de thérapie génique qui collabore avec la Fondation Loulou sur la thérapie génique du CDD, il a expliqué comment son équipe a très tôt compris que, pour obtenir des thérapies géniques, il faudrait combattre le système immunitaire, même s’il leur a fallu 17 ans pour appréhender précisément certains des principaux défis. Il a découvert l’AAV9 et a depuis lancé plusieurs essais cliniques de thérapies utilisant à la fois l’AAV9 et ses nouvelles générations de virus. Jim a consacré la dernière partie de son intervention à un sujet crucial dans le domaine des maladies rares : les récents décès de patients lors d’essais cliniques avec administration intraveineuse de fortes doses d’AAV. Son laboratoire a étudié la toxicité des thérapies géniques sur près de 500 singes, et Jim a plaidé pour une plus grande transparence dans ce domaine afin que, lorsqu’une entreprise déplore un décès de patient au cours d’un essai, elle partage les données expliquant précisément les circonstances de ce décès. C’est la seule façon pour Jim et d’autres de développer des tests précliniques (sur animaux) afin d’anticiper ce problème de sécurité avant qu’il ne survienne lors d’un essai clinique.
Andrew Steinsapir, de la société Apertura Gene Therapy, a présenté la capside (virus) qu’ils développent pour les maladies neurologiques et qui est administrée par voie intraveineuse. Ce virus est conçu pour traverser la barrière hémato-encéphalique en se liant à des récepteurs du système sanguin cérébral. Des thérapies antérieures utilisant de grosses protéines (mais pas encore de virus) capables de traverser la barrière hémato-encéphalique via ce même récepteur ont déjà été décrites. L’équipe d’Apertura estime donc qu’aucun problème inattendu ne devrait survenir lors des premiers essais cliniques. Si son innocuité est démontrée lors des essais, ce type de virus pourrait permettre de créer une deuxième génération de thérapies géniques pour le CDD, qui, au lieu d’être administrées par un chirurgien dans le liquide céphalo-rachidien, pourraient être simplement injectées par voie intraveineuse.
Enfin, le Dr Basel Assaf, toxicologue de renom chez Attentive Science, a appuyé les propos de Jim Wilson : jusqu’à présent, l’utilisation de singes (primates non humains) a permis d’anticiper tout problème de toxicité susceptible d’apparaître ultérieurement chez les patients. Cependant, cette méthode n’est pas infaillible, et un décès récent est survenu lors d’un essai clinique portant sur une autre maladie neurologique rare, traité par thérapie génique intraveineuse. Ce décès n’avait pas été prédit par les études sur les singes. Le Dr Assaf a également illustré de façon pertinente la notion de « fortes doses » : une thérapie génique intraveineuse peut utiliser sept quadrillions de virus, soit plus que le nombre de cellules de notre corps !
Rappelons que les thérapies géniques développées par Ultragenyx, la Fondation Loulou et l’UC Davis ne sont PAS administrées par voie intraveineuse à forte dose. Elles utilisent des doses plus faibles, injectées directement dans le liquide céphalo-rachidien.
En résumé : le domaine de la thérapie génique apprend à connaître les risques liés à la sécurité, ce qui exige transparence et collaboration. Plusieurs pistes sont en cours pour développer une thérapie génique contre le CDD, avec la possibilité d’un premier essai clinique en 2027. Le message principal de cette session sur la thérapie génique est très positif. Comme l’a exprimé un père d’enfant atteint de CDD sur les réseaux sociaux : « Un véritable changement est en marche. »
4. Nous sommes probablement prêts à mener des essais cliniques complexes.

Image: Panel discussion “Where do we stand today with clinical outcome measures for CDD?”. Dr Xavier Liogier (Loulou Foundation); Dr Barry Ticho (Stoke Therapeutics); Dr Heather Olson (BCH); Dr Jenny Downs (Kids Research Institute, Perth); missing in the image Prof Tim Benke (University of Colorado); Dr Billy Dunn (Loulou Foundation, former FDA)
Depuis environ cinq ans, on entend parler du développement et de la validation de mesures de résultats pour les essais cliniques sur le CDD, permettant d’évaluer des symptômes autres que les crises d’épilepsie.
D’après les présentations du Forum 2025, il semble que 80 % du travail soit accompli, et si nous devions lancer un essai clinique de thérapie génique demain, nous saurions quelles mesures inclure.
Le Dr Xavier Liogier, de la Fondation Loulou, a présenté les dernières avancées de l’étude internationale CANDID, validant pour le CDD des échelles utilisées pour mesurer la cognition, le comportement et la motricité dans d’autres maladies, et acceptées par les autorités réglementaires pour l’autorisation de mise sur le marché des médicaments. D’ici décembre, CANDID suivra 100 patients pendant deux ans à l’aide de cet ensemble d’échelles, fournissant des données longitudinales sur l’évolution attendue sur cette période. Plusieurs échelles et sous-échelles sont adaptées au CDD, et un article est en cours d’évaluation en vue de sa publication. L’un des enseignements de l’étude CANDID, aux implications importantes pour les essais cliniques, est que les patients atteints de CDD présentent une à cinq crises par jour ; la plupart d’entre eux seront donc éligibles aux essais cliniques en cours sur l’épilepsie. C’est beaucoup plus fréquent que pour d’autres syndromes épileptiques.
Le professeur Tim Benke de l’Université du Colorado et la docteure Jenny Downs du Kids Research Institute de Perth ont présenté leurs travaux sur le développement de nouvelles échelles cliniques spécifiquement adaptées aux personnes atteintes de CDD. L’étude clinique dirigée par Tim est sur le point d’inclure 100 patients au suivi de deux ans et, point important, elle comprend également des études EEG qui pourraient permettre d’identifier un biomarqueur pour observer les effets d’une thérapie génique sur le cerveau. Parallèlement, Jenny développe une nouvelle échelle de communication pour les personnes atteintes de CDD, un aspect souvent prioritaire pour les familles. Un ancien directeur de la FDA a salué le travail technique rigoureux et approfondi qu’ils accomplissent dans le cadre de ce développement.
Lors d’une table ronde qui a suivi, les intervenants — notamment l’ancien directeur de la FDA, le Dr Billy Dunn, et le directeur médical de Stoke Therapeutics, le Dr Barry Ticho — ont souligné que les essais cliniques et les soins aux patients ont des objectifs différents.
Alors que les soins aux patients exigent de prendre en compte toute la complexité du trouble et de se concentrer sur ce qui compte le plus pour chaque patient, « il n’est pas nécessaire de tout montrer sous le soleil [dans les essais] pour faire approuver un médicament ».
Billy Dunn a mis en garde contre le risque de « créer des obstacles involontaires » pour les essais cliniques, et a conseillé aux développeurs qu’« il n’est pas obligatoire d’inclure tout dans l’essai ni de tout mentionner sur l’étiquette ».
Il a plutôt recommandé d’utiliser des études post-approbation pour obtenir une vision plus large du potentiel du médicament, et de laisser les médecins explorer la valeur pour chaque patient une fois le médicament approuvé.
En résumé : des progrès considérables ont été réalisés dans le développement et la validation d’échelles cliniques pour les essais cliniques sur le CDD, au-delà des crises d’épilepsie. Grâce à ces travaux, si nous devions lancer demain un essai clinique de thérapie génique, nous saurions quelles mesures inclure. Ceci a été rendu possible grâce à la participation de centaines de familles touchées par le CDD depuis deux ans (voire plus pour certaines !) à ces études observationnelles, où elles ne retirent aucun bénéfice direct, mais seulement des difficultés. Vous pouvez tous être fiers d’avoir rendu cela possible !
5. Une communauté mondiale forte et une alliance mondiale porteuse d’espoir

Image: Lili Hass message and picture (CURE5); Dr Maria Luisa Tutino message; Dr Maria Luisa Tutino together with Lynn and Majid Jafar; Dr Katheryn Frame presentation and picture (CDKL5 Alliance)
La communauté internationale, et en particulier l’Alliance des patients CDKL5, a été maintes fois qualifiée d’« alliance mondiale porteuse d’espoir », unie autour des personnes plutôt que des données ou des molécules.
Au-delà des seuls groupes de patients, la collaboration entre scientifiques, cliniciens, entreprises et représentants de patients a été saluée pour avoir accéléré les progrès, des connaissances moléculaires aux thérapies contre la CDD. En reconnaissance de cette collaboration, le Forum CDKL5 a décerné des Prix d’excellence à UCB Pharma, entreprise ayant le plus contribué à faire la différence, au Dr Kyle Fink de l’UC Davis, le prix du Laboratoire de l’année, et au Dr Massimiliano Bianchi, le prix du Champion du progrès. Plusieurs bourses de recherche junior ont également été attribuées.
Le Forum s’est ouvert sur le témoignage d’une patiente, Lili Hass, mère de Margot et cofondatrice de CURE5, qui a partagé l’histoire de sa famille et déclaré : « Les crises d’épilepsie ne sont que la partie émergée de l’iceberg ; les défis liés au développement sont le plat principal. » Elle a exhorté les scientifiques à rechercher davantage de bénéfices thérapeutiques et à explorer d’autres pistes que les médicaments, en s’intéressant notamment aux outils susceptibles de faciliter le quotidien des familles comme la sienne, tels que du matériel médical, des innovations en matière d’alimentation et de meilleures méthodes de suivi des données à domicile.
Le Dr Maria Luisa Tutino, à la fois mère d’Elettra et chercheuse en protéines, est intervenue lors du dîner de gala. Elle a expliqué que la science ne se résume pas à des expériences, mais qu’elle est avant tout une affaire de personnes, de liens et de persévérance. Allyson Berent, de la Fondation FAST Angelman, a fait écho à ces propos, insistant sur l’urgence et la persévérance, elle aussi mère d’un enfant atteint d’une maladie rare et scientifique.
Et le Dr Katheryn Frame, mère de Kiera, a prononcé le dernier discours en tant que présidente de l’Alliance CDKL5. Elle a évoqué « un monde d’espoir partagé » et a souligné le travail accompli par de nombreuses associations de patients atteints de CDD à travers le monde. Katheryn a expliqué que pour elle, « être unis dans l’espoir signifie force, détermination, résilience, compassion et solidarité ».
Majid Jafar, père d’Alia et cofondateur de la Loulou Foundation, a clôturé la réunion en rappelant que le développement de l’Alliance CDKL5 contribue largement à la force de cette collaboration. Comme lors des précédentes éditions du Forum, il a souligné que nous avions progressé plus vite et plus loin que nous ne l’avions imaginé, mais jamais autant que les familles le souhaiteraient. Majid a exhorté les participants à renouveler leur engagement dans la recherche de traitements pour la CDD et les a invités à se retrouver dans un an pour le Forum CDKL5 2026 à Londres, au Royaume-Uni.
Et voilà, c’est la fin du Forum CDKL5 2025 ! Nous y avons découvert des aspects inattendus de la biologie du gène CDKL5 qui ouvrent de nouvelles perspectives thérapeutiques, constaté un nombre record de familles éligibles aux essais cliniques et ressenti les progrès des thérapies géniques pour le CDD comme jamais auparavant. Ce forum a été une réussite.
J’espère que ce résumé vous a plu et je vous retrouve à Londres.
Ana Mingorance, PhD
Avertissement : Ce résumé, qui met en lumière les principaux enseignements du Forum, est personnel et ne constitue pas un compte rendu officiel de la Fondation Loulou. Ces textes sont rédigés à l’intention des parents d’enfants atteints de CDD ; veuillez donc excuser certaines imprécisions techniques.
